العدد الذري والعدد الكتلي
العناصر: مواد كيميائية تتكون من ذرة وحيدة وفريدة من نوعها، الذرة هي أصغر وحدة بنائية في المادة، وتتكون من النواة ومن المحيط الخارجي، والنواة جسيم صغير يحمل الشحنة الموجبة ويشكل 99.9% من وزن الذرة، وتحتوي على البروتونات والنيوترونات، وتوجد العناصر بشكل طبيعي مثل الأكسجين، أو من صنع الإنسان مثل البروم، ويتم تصنيف العناصر حسب موقعها في الجدول الدوري، إلى فلزات ولا فلزات وأشباه فلزات، ويتم التمييز بين العناصر حسب أعدادها الذريّة، كما أنها توجد بثلاث حالات، الحالة الصلبة والسائلة والغازية.
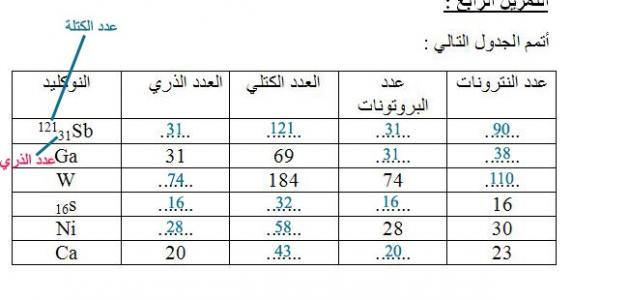
العدد الذري
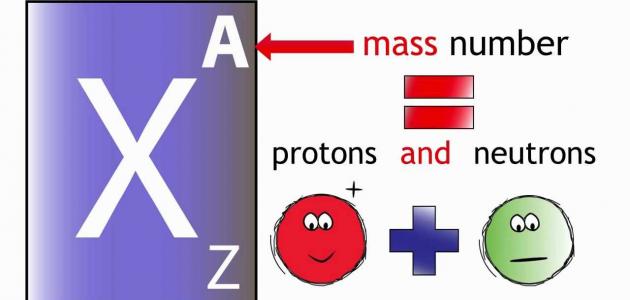
هو عدد البروتونات الموجودة داخل نواة الذرة، وهو ما يميز كل ذرة عنصر عن ذرة العنصر الآخر، وهو الذي يحدد نوع العنصر وخصائصه وصفاته الكيميائية والفيزيائية، ويبدأ العدد الذري للعناصر من 1، وهو العدد الذري الخاص بذرة الهيدروجين، وأعلى عدد ذري هو 92، وهو العدد الذري الخاص بذرة اليورانيوم، وفي حال فقد أي عنصر بروتوناً من بروتوناته أو أضاف إليها بروتوناً، يتحول إلى عنصر آخر، مثل ذرة الهيليوم تحتوي على بروتونين، وفي حال فقدان أحدهما تتحول إلى ذرة هيدروجين، والعكس صحيح، ولكن هذه العملية ليست سهلة وتحتاج إلى طاقة كبيرة لفك تماسك الذرة، ويكتب العدد الذري في أسفل رمز العنصر.
العدد الكتلي
هو عدد الجسيمات الثقيلة الموجودة في النواة، ومجموع عدد البروتونات وعدد النيوترونات، ويكتب العدد الكتلي على يسار رمز العنصر من أعلى، ولحساب عدد البروتونات والنيوترونات في الذرة، يجب استخدام الجدول الدوريّ، حيث يمثل الرقم الظاهر عند كل عنصر، ويؤدي ازدياد العدد الكتلي إلى امتلاك الذرات خصائص فيزيائية مشعة، وغير مستقرة، ويحدث لها انشطار من أجل الوصول إلى حالة الاستقرار، وكلما كان العدد الكتلي صغيراً تكون الذرة خفيفة، ويحدث لها اندماج للوصول إلى حالة الاستقرار.
استخدام العدد الذري والعدد الكتلي
يتم استخدام العدد الذري والعدد الكتلي من أجل تكوين صورة كاملة عن الذرة، من حيث الصفات والخصائص، ومدى قوة تمسك النواة بالذرات.
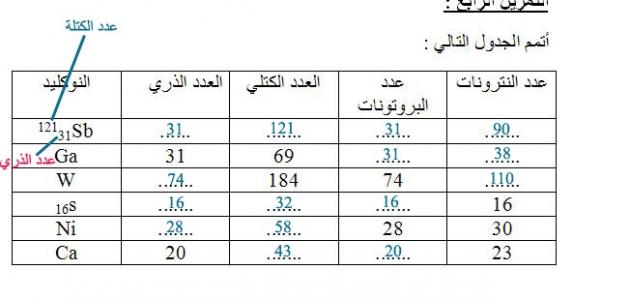
- مثال (1): ذرة الكربون، العدد الذري لها هو 6، والعدد الكتلي هو 12، ما هو عدد النيوترونات؟
- الحل: من خلال طرح العدد الكتلي من العدد الذري، نستطيع الحصول على عدد النيوترونات أي أنّ عدد النيوترونات =12–6=6.
- مثال (2): العدد الذري لليثيوم يساوي 3، وكتلته الذرية تساوي 7، ما عدد البروتونات والنيوترونات والإلكترونات في ذرة الليثيوم؟
- العدد الذري = 3، إذاً عدد البروتونات = 3، عدد الإلكترونات = 3.
- العدد الكتلي = 7، إذاً عدد النيوترونات = العدد الكتلي - العدد الذري = 7 - 3 = 4.
المقالات المتعلقة بالعدد الذري والعدد الكتلي