
محتويات
- ١ الذرة
- ٢ العدد الذري والكتلي
- ٢.١ العدد الذري
- ٢.٢ طرق كتابة العدد الذري والكتلي
الذرة هي أصغر وحدة بنائية للمادة أي أنّها غير قابلة للإنقسام، بالإنجليزية (Atom)، والذرة هي الجزء الذي يحتفظ ويخزن بداخله الخصائص والصفات الكيميائية لهذه المادة. تتكون الذرة من جسيمات، هذه الجسيمات هي البروتونات التي تحمل الشحنة الموجبة، والنيوترونات وهي لا تحمل شحنة، والإلكترونات التي كتلتها أقل من كتلة البروتونات، والنيوترونات ولها شحنة سالبة، وتعرف الذرة بأنّها متعادلة الشحنة، وذلك لأنّ عدد البروتونات فيها يساوي عدد الإلكترونات (أي أنّ الشحنات الموجبة تساوي عدد الشحنات السالبة)، وتكون الذرّة مستقلة عندما يتساوى عدد البروتونات مع عدد النيوترونات، أمّا عند عدم تساوي عددهما معاً فإنّ الذرة في هذه الحالة تسمّى ذرة مشعة.
العدد الذري والكتليعند دراسة الكيمياء، والفيزياء بشكل عام، ودراسة الذرة بشكل خاص يظهر مصطلحان أساسيان ومهمان يجب تعلمهما، وهما العدد الكتلي للذرة، والعدد الذري.
- العدد الكتلي: هو مجموع عدد البروتونات مع عدد النيوترونات الموجودة في ذرة عنصر معين، يرمز له بالرمز (A).
- العدد الذري: هو هدد البروتونات، أو الإلكترونات في الذرة.
- يعرف بالإنجليزية (Atomic number)، والمقصود به هو عدد البروتونات، أو الإلكترونات التي تحملها الذرة وهو يختلف من ذرة عنصر إلى ذرة عنصر آخر.
- يرمز له بالرمز (Z).
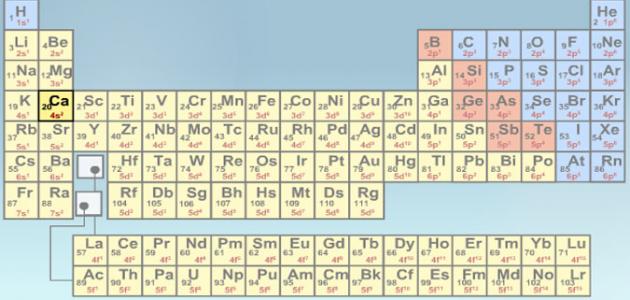
- كل عنصر من عناصر الجدول الدوري له عدد ذري مختلف عن أي عنصر آخر، أي أنّ العدد الذري يستخدم لتحديد نوع العنصر الكيميائي.
- بعد ترتيب العناصر في الجدول الدوري حسب عددها الذري من قبل الكيميائي الروسي ديمتري مندليف، ثمّ تبعه بعد ذلك العديد من العلماء مع بعض التعديلات، اكُتُشِفَ أن الخواص الكيميائية للعناصر في الجدول الدوري تتكرّر بشكل دوري.
- أي أنّ العناصر ذات الخواص الكيميائية المتشابهة مرتبة مع بعضها بشكل عمودي في الجدول الدوري.
- تُرتب العناصر في الجدول الدوري كما ذكر سابقأ حسب عددها الذري وبشكل تصاعدي،حيث يبدأ الجدول الدوري بعنصر الهيدروجين لذي عدده الذري 1، ثمّ ننتقل في الجدول الدوري بشكل أفقي.
- لكلّ عنصر كيميائي رمز كيميائي مأخوذ من الاسم اللاتيني لهذا العنصر.
- عند كتابة العدد الذري للعنصر فإنّنا نكتبه إلى الأسفل من يسار رمز العنصر.
- مثال ذلك: العدد الذري للصوديوم هو 11 ويكتب كالتالي، 11Na.
- عند كتابة العدد الكتلي للعنصر فإنّنا نكتبه إلى الأعلى من يسار رمز العنصر.
- مثال ذلك: العدد الكتلي للصوديوم هو هو 23 ويكتب كالتالي، 23Na
- العدد الكتلي والعدد الذري للعنصر يكتبان معاً على العنصر الكتالي، 2311Na
المقالات المتعلقة بأين يكتب العدد الذري للعنصر