
محتويات
- ١ الجدول الدوري
- ٢ العدد الكتلي
- ٣ العدد الذري
- ٤ حساب عدد البروتونات والنيوترونات
- ٥ أثر ازدياد العدد الكتلي على الذرات
تختلف العناصر عن بعضها البعض في خصائص كثيرة سواء في الخصائص الفيزيائية والكيميائية مثل الكثافة أو حالة المادة أو لونها أو شدة تفاعلها ونتواجها، فقد تم وضع الجدول الدوري في بداية الأمر حسب التزايد في العدد الكتلي، ولكن عند ترتيب هذه العناصر على هذا الأساس لم يكن هنالك دوريّة في الجدول ولم يتم ترتيب العناصر على شكل مجموعات لها الخصائص الفيزيائيّة نفسها، فتم بعد ذلك ترتيبه حسب تزايد العدد الذريّ، فوضعت العناصر التي تشترك بالصفات نفسها في مجموعة واحدة، ومن خلال هذا المقال سوف نتعرف على مفهوم العدد الكتلي والعدد الذري وكيفيّة حساب هذه الأعداد وما أثر ازدياد العدد الكتلي على العناصر.
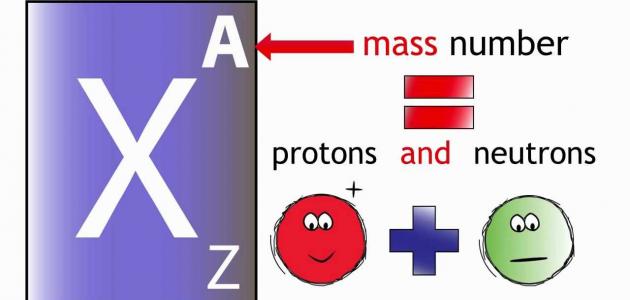
العدد الكتليالعدد الكتلي عبارة عن عدد البروتونات والنيوترونات في الذرة، توجد البروتونات والنيوترونات في نواة الذرة على الرغم من أنّ شحنة البروتونات موجبة والنيوترونات متعادلة الشحنة، لكن بسبب وجود القوى النوويّة الشديدة فإن هذه الجسيمات تبقى مستقرة داخل النواة، أي أنها لا تتنافر لأنّ القوى النووية الشديدة أقوى بمئة وثلاثين مرة من القوة الكهربائيّة ( قوة كولوم)، ومن خلال الأبحاث العلميّة والتجارب النووية على الجسيمات وجد العلماء ذرات لها العدد الذري نفسه، ولكن تختلف في العدد الكتلي وسمّيت هذه بالنظائر، حيث تشترك هذه النظائر ببعض الصفات الفيزيائيّة والكيميائية ولكن نسبة وجودها في الطبيعة تختلف من نظير إلى آخر ومن أشهر النظائر الموجودة نظير الكربون المشع، والذي من خلاله نستطيع معرفة عمر الأحفورات والهياكل العظمية القديمة وعمر الصخور وطبقات الأرض والنباتات.
العدد الذرييمثل العدد الذري عدد البروتونات الموجودة داخل نواة الذرة، حيث تؤدي الزيادة في عدد البروتونات إلى اختلاف خصائص العناصر، إذ لا توجد في الطبيعة ذرّتان مختلفتان في عدد البروتونات ومتشابهتان في الخصائص الفيزيائيّة والكيميائية، لذلك فقد تم ترتيب الجدول الدوري حسب تزايد العدد الذري، مما ساهم في ترتيب الجدول على شكل صفوف وأعمدة بحيث يحتوي كل عمود على عناصر مشتركة في الخصائص الفيزيائيّة والكيميائية، وبسبب هذا الترتيب فقد أعطى لهذا الجدول خاصية الدوريّة أي أن خصائص العناصر تتكرر كل ثماني مجموعات.
حساب عدد البروتونات والنيوتروناتلحساب عدد البروتونات والنيوترونات في الذرة يمكننا استخدام الجدول الدوريّ لمعرفة عدد البروتونات حيث تمثل الرقم الظاهر عند كل عنصر، ونستطيع معرفة عدد النيوترونات من خلال طرح العدد الكتلي من العدد الذري كما هو موضح في المثال التالي: ذرة الكربون والتي العدد الذري لها يساوي ستة، والعدد الكتلي لها اثنا عشر فمن خلال طرح العدد الكتلي من العدد الذري نستطيع الحصول على النيوترونات أي أنّ:
- عدد النيوترونات = العدد الكتلي – العدد الذريّ.
- عدد النيوترونات = 12 – 6 = 6 نيوترونات.
إن ازدياد العدد الكتلي للذرات يجعلها غير مستقرة، ويجعلها تمتلك خصائص فيزيائيّة مشعة، فكلما كان العدد الكتلي كبيراً تكون الذرة ثقيلة وغير مستقرة ويحدث فيها انشطار للوصول إلى حالة الاستقرار، وعلى عكس ذلك كلما كان العدد الكتلي صغيراً تكون الذرة خفيفة ويحدث لها اندماج للوصول إلى حالة الاستقرار.
المقالات المتعلقة بالعدد الكتلي