
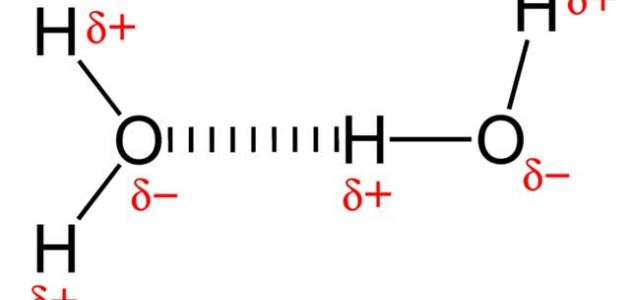
المركبات القطبيّة
وتعرف القطبيّة الكيميائية بأنها عملية فصل الشحنات الكهربائية عن بعضها البعض بشكل جزئيّ، وتؤدي بالتالي إلى إكساب العنصر الكيميائي عزماً ثنائيّ القطب، وتلعب الرابطة الهيدروجينية دوراً هاماً في ترابط الجزيئات القطبيّة بين بعضها البعض، وكما تعتمد القطبيّة الجزئية في اختلافها على السالبية الكهربائية للذرات التي تختلف فيما بين الجزيئات.
ومن الأمثلة على المركبات القطبيّة الماء ويعتبر كذلك نظراً لعدم وجود توازن في التوزيع الإلكتروني بين ترابط ذرتي الهيدروجين مع الأكسجين، أما بالنسبة للمركبات غير القطبيّة فمنها الميثان، ويصنّف بناءً على التوازن الموجود في التقاسم الإلكتروني بين ذرتي الكربون والهيدروجين، وتترك القطبيّة الكهربائية أثراً واضحاً على المركبات من حيث التوتر السطحي والانحلالية إلى جانب نقطتي الغليان والانصهار.
تؤدي نظرية القطبيّة الكيميائية إلى حدوث عدد من الظواهر، ومنها ظاهرة طفو الأجسام على سطح الماء، وكما تفسر أيضاً ظاهرة تجمد سطح المسطحات المائية أولاً ثم أسفلها.
وبوصف مختصر فإنّ المركب القطبي محصّلته أكثر من صفر، ولا يمكن لها أن تساوي ذلك، ومن الأمثلة على ذلك فإن مركب H2O محصلته لا تساوي صفراً؛ نظراً لحدوث حركة على الإلكترونات نحو الأكسجين، وذلك لأنّ ذرات الأكسجين أقوى من الهيدروجين.
القطبيّة في الجزيئاتيعتبر أمر وصف المركبات على أنها قطبيّة أو غير قطبيّة أمراً نسبياً للغاية، وتمتلك المركبات القطبيّة خصائص نموذجية للجزيئات، وهي:
- الجزيئات القطبيّة: ومن أكثر الجزيئات القطبيّة شيوعاً هي السكر والمعروف علميّاً بالسكروز إذ يتألف من ارتباط جزيئين من الفركتوز والجلوكوز، ويدخل في السكروز عدد من الروابط القطبيّة بين ذرتي الأكسجين والهيدروجين، وكذلك الأمر بالنسبة لجزيء الماء.
- الجزيئات غير القطبيّة: ومن الأمثلة على المركبات غير القطبيّة هي الدهون والزيوت والبنزين، ويعتبر هذا النوع من الجزيئات غير قابل للذوبان بالماء، إلا أنّ هناك نوعاً من المذيبات العضوية غير القطبيّة لديها القدرة على إذابة المواد القطبيّة وحلها.
- الجزيئات الهجينة: تعرف الجزيئات الهجينة بأنها تلك الجزيئات ذات الحجم الكبير، وتمتاز بامتلاكها نهاية وحدة برابطة قطبيّة لها ارتباط مع مجموعة أخرى من الجزيئات تمتلك نهايات غير قطبيّة، وتلعب هذه المركبات دوراً في تشكيل المستحلبات المستقرة، أو مزيج من الماء والدهون، وتساهم أيضاً في خفض التوتر السطحي بين جزيئات الزيت والماء بالاعتماد على الامتزاز.
المقالات المتعلقة بالمركبات القطبية